A.
PENDAHULUAN
Tujuan :
· Memahami cara melakukan ekstraksi dengan metode
perkolasi.
· Memahami tentang pengaruh waktu ekstraksi daun teh
terhadap kadar kafein yang ditetapkan
secara KLT-Densitometri.
· Memahami cara melakukan ekstraksi dengan metode
ultrasonik serta membandingkan kromatogram dari ekstrak secara kualitatif.
Praktek Ekstraksi. Ekstraksi adalah suatu proses pemisahan dari bahan padat maupun cair
dengan bantuan pelarut. Pelarut yang digunakan harus dapat mengekstrak
substansi yang diinginkan tanpa melarutkan material lainnya. Faktor-faktor yang
mempengaruhi laju ekstraksi
Antara lain : Tipe persiapan sampel,
Waktu ekstraksi, Kuantitas pelarut, Suhu pelarut dan Tipe pelarut.
Pada praktikum ini ekstraksi dilakukan dengan
Metode Perkolasi. Perkolasi
adalah proses penyarian simplisia dengan jalan melewatkan pelarut yang sesuai
secara lambat pada simplisia dalam suatu perkolator. Perkolasi bertujuan supaya
zat berkhasiat tertarik seluruhnya dan biasanya dilakukan untuk zat berkhasiat
yang tahan ataupun tidak tahan pemanasan Prinsip perkolasi adalah sebagai
berikut: serbuk simplisia di tempatkan dalam suatu bejana silinder, yang bagian
bawahnya diberi sekat berpori. Cairan penyari dialirkan dari atas ke bawah
melalui serbuk tersebut, cairan penyari akan melarutkan zat aktif sel-sel yang
dilalui sampai mencapai keadaan jenuh. Gerak kebawah disebabkan oleh kekuatan
gaya beratnya sendiri dan cairan diatasnya, dikurangi dengan daya kapiler yang
cenderung untuk menahan. Kekuatan yang berperan pada perkolasi antara lain:
gaya berat, kekentalan, daya larut, tegangan permukaan, difusi, osmosa, adesi,
daya kapiler dan daya geseran (friksi). Secara umum proses perkolasi ini
dilakukan pada temperatur ruang. Sedangkan parameter berhentinya penambahan
pelarut adalah perkolat sudah tidak mengandung senyawa aktif lagi. Pengamatan
secara fisik pada ekstraksi bahan alam terlihat pada tetesan perkolat yang
sudah tidak berwarna.
Pengujian
Pengaruh waktu Ekstraksi Terhadap Mutu Ekstrak. Kromatografi adalah suatu teknik pemisahan molekul berdasarkan perbedaan pola pergerakan antara fase gerak dan fase diam
untuk memisahkan komponen (berupa molekul) yang berada pada larutan. Molekul
yang terlarut dalam fase gerak, akan melewati kolom yang merupakan fase diam.
Molekul yang memiliki ikatan yang kuat dengan kolom akan cenderung bergerak
lebih lambat dibanding molekul yang berikatan lemah. Dengan ini, berbagai macam
tipe molekul dapat dipisahkan berdasarkan pergerakan pada kolom. Diantara
berbagai jenis teknik kromatografi, kromatografi lapis tipis (KLT) adalah yang
paling cocok untuk analisis obat di laboratorium, karena cara ini khas dan
mudah dilakukan untuk pelarut dan cuplikan yang jumlahnya sedikit,. Selain itu penggunaannya
yang relatif cepat serta harga alat yang tidak terlalu mahal merupakan
kelebihan metode ini.
Adapun
prinsip kerjanya yaitu memisahkan sampel berdasarkan perbedaan kepolaran antara
sampel dengan pelarut yang digunakan. Teknik ini biasanya menggunakan fase diam
dari bentuk plat silika dan fase geraknya disesuaikan dengan jenis sampel yang
ingin dipisahkan. Larutan atau campuran larutan yang digunakan dinamakan eluen.
Semakin dekat kepolaran antara sampel dengan eluen maka sampel akan semakin
terbawa oleh fase gerak tersebut. Semua kromatografi memiliki fase diam (dapat
berupa padatan, atau kombinasi cairan-padatan) dan fase gerak (berupa cairan
atau gas). Fase gerak mengalir melalui fase diam dan membawa komponen-komponen
yang terdapat dalam campuran. Komponen-komponen yang berbeda bergerak pada laju
yang berbeda. campuran pelarut pengembang dan fasa diamnya dapat berupa serbuk
halus yang berfungsi sebagai permukaan penyerap (kromatografi cair-padat) atau
berfungsi sebagai penyangga untuk lapisan zat cair (kromatografi cair-cair).
Fasa diam pada KLT sering disebut penyerap walaupun berfungsi sebagai penyangga
untuk zat cair di dalam sistem kromatografi cair-cair. Hampir segala macam
serbuk dapat dipakai sebagai penyerap pada KLT, contohnya silika gel (asam
silikat), alumina (aluminium oksida), kiselgur (tanah diatomae) dan selulosa.
Silika gel merupakan penyerap paling banyak dipakai dalam KLT.
Penggunaan ultrasonik
pada dasarnya menggunakan menggunakan prinsip dasar yaitu dengan mengamati
sifat akustik gelombang ultrasonik yang dirambatkan melalui medium yang
dilewati. Pada saat gelombang merambat, medium yang dilewatinya akan mengalami
getaran. Getaran akan memberikan pengadukan yang intensif terhadap proses
ekstraksi. Pengadukan akan meningkatkan kemampuan penetrasi pelarut ke dalam
sel bahan sehingga meningkatkan proses ektraksi. Dengan adanya gelombang
ultrasonik juga meningkatkan permeabilitas dinding sel, menimbulan gelembung
spontan (cavitation) sebagai stres dinamik serta menimbulkan fraksi interfase. Cara kerja metode ultrasonik dalam mengekstraksi adalah sebagai
berikut : gelombang ultrasonik terbentuk dari pembangkitan ultrason secara
lokal dari kavitasi mikro pada sekeliling bahan yang akan diekstraksi sehingga
terjadi pemanasan pada bahan tersebut, sehingga melepaskan senyawa ekstrak.
Terdapat efek ganda yang dihasilkan, yaitu pengacauan dinding sel sehingga
membebaskan kandungan senyawa yang ada di dalamnya dan pemanasan lokal pada
cairan dan meningkatkan difusi ekstrak. Energi kinetik dilewatkan ke seluruh
bagian cairan, diikuti dengan munculnya gelembung kavitasi pada dinding atau
permukaan sehingga meningkatkan transfer massa antara permukaan padat-cair.
Hal-hal yang mempengaruhi kemampuan ultrasonik untuk menimbulkan efek kavitasi
antara lain karakteristik ultrasonik seperti frekuensi getaran, intensitas getaran, kapasitas alat,
proses ultrasonik dan kondisi sekitar seperti suhu dan tekanan. Selanjutnya efek mekanik yang ditimbulkan
adalah meningkatkan penetrasi dari cairan menuju dinding membran sel, mendukung
pelepasan komponen sel, dan meningkatkan transfer massa (Keil, 2007). Liu et al. (2010), menyatakan bahwa kavitasi
ultrasonik menghasilkan daya patah yang akan memecah dinding sel secara mekanis
dan meningkatkan transfer material.
B.METODE PRAKTIKUM
Alat :
Perkolator, Kapas, Botol penampung, Spektrofotometri,
Timabangan Analitik, Pipet Volume, Pipet Filler, Corong Pisah, Lempeng Klt Silica Gel 60 F254, Kertas
Saring, Waterbath, Vial, KLT chamber, Peralatan ekstraksi ultrasonic,
dan Alat-Alat Gelas Lain (Beaker Glass,
Pengaduk Gelas, Corong Gelas, Labu Ukur).
Bahan :
Rimpang
Temulawak, Etanol 96%, Daun Teh, Pembanding
Kafein, Kalsium Karbonat, Kloroform,
Toluen, Etil Asetat, Dietil Amin,
Pereaksi Dragendorf, Rimpang Kunyit, Benzena, Naoh 5%.
C. HASIL PRAKTIKUM DAN PEMBAHASAN
1. Ekstraksi dengan Metode
Perkolasi.
•
Bahan yang digunakan: Rimpang
temulawak, Etanol 96% sebagai menstrum
•
Hasil :
- Volume : 200ml
- Warna : Coklat kekuningan
- Larutan tampak jernih
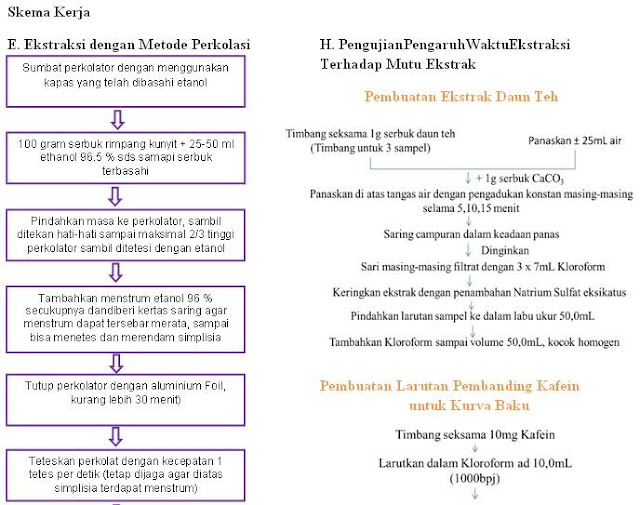
Pada praktikum ini simplisia yang digunakan
adalah rimpang kunyit dengan menggunakan cairan penyari etanol 96%. Pertama-tama serbuk simplisia dibasahi
dengan etanol 96 % sampai serbuk simplisia terbasahi semua. Tujuan pembasahan
serbuk simplisia adalah agar serbuk simplisia yang mau di ekstraksi tidak
mengalami pembengkakkan sel secara tiba-tiba di dalam alat perkolator (dapat
menyebabkan menstrum sulit mengalir), menjaga keseragaman kelembapan simplisia
sehingga mencegah pembentukan saluran-saluran, meningkatkan porositas dinding
sel sehingga meningkatkan difusi
substansi terekstraksi dari sel ke dalam menstrum atau penembusan sel oleh
menstrum.
Selanjutnya Perkolator yang akan
digunakan terlebih dahulu dibersihkan dan diberi kapas yang dibasahi etanol pada
bagian bawah perkolator agar serbuk simplisia tidak keluar melalui bagian bawah
perkolator. Jika ada serbuk simplisia yang keluar maka akan menyebabkan
perkolat menjadi keruh. Serbuk simplisia yang telah terbasahi semua dipindahkan
sedikit demi sedikit ke dalam perkolator yang telah disiapkan, sambil
ditambahkan etanol 96%, kemudian letakkan kertas saring di atas serbuk
simplisia. Kertas saring berfungsi agar pada saat penambahan menstrum, serbuk
simplisia tidak bertebaran ke dinding perkolator. Setelah itu ditambahkan
menstrum etanol 96% secara perlahan-lahan melewati dinding perkolator sampai
tinggi menstrum 1 – 1,5 cm di atas simplisia. Kemudian perkolator ditutup
dengan aluminium foil untuk mencegah etanol menguap. Setelah itu ditunggu selama 30 menit untuk memberikan waktu
simplisia berdifusi ke dalam menstrum. Perkolat diteteskan dengan kecepatan
1tetes/detik sampai diperoleh volume 200 ml (sambil dijaga menstrum selalu
berada di atas simplisia). Dari hasil praktikum kami, perkolat yang didapatkan
jernih dan berwarna coklat kekuningan.
1.
Pengujian
Pengaruh Waktu Ekstraksi Terhadap Mutu Ekstrak
ü Perhitungan Kadar Kafein
Kadar kafein = 10 mg / 10 ml
= 10 mg / 0.01 L
= 1000 mg / L
= 1000 bpj
ü Perhitungan pengenceran Kafein
- 1 ml 50 bpj diambil dari x
µL (1000 bpj)
V1 . Kadar = V2 . Kadar
1 ml . 50 bpj = x . 1000 bpj
X = 0.05ml = 50 µL
(Sehingga CHCl3 yang digunakan adalah 950 µL)
- 1 ml 100 bpj diambil dari x
µL (1000 bpj)
V1 . Kadar = V2 . Kadar
1 ml . 100 bpj = x . 1000 bpj
X = 0.1ml = 100 µL
(Sehingga CHCl3 yang digunakan adalah 900 µL)
- 1 ml 200 bpj diambil dari x
µL (1000 bpj)
V1 . Kadar = V2 . Kadar
1 ml . 200 bpj = x . 1000 bpj
X = 0.2ml = 200 µL
(Sehingga CHCl3 yang digunakan adalah 800 µL)
- 1 ml 300 bpj diambil dari x
µL (1000 bpj)
V1 . Kadar = V2 . Kadar
1 ml . 300 bpj = x . 1000 bpj
X = 0.3ml = 300 µL
(Sehingga CHCl3 yang digunakan adalah 700 µL)
- 1 ml 400 bpj diambil dari x
µL (1000 bpj)
V1 . Kadar = V2 . Kadar
1 ml . 400 bpj = x . 1000 bpj
X = 0.4ml = 400 µL
(Sehingga CHCl3 yang digunakan adalah 600 µL)
- 1 ml 500 bpj diambil dari x
µL (1000 bpj)
V1 . Kadar = V2 . Kadar
1 ml . 500 bpj = x . 1000 bpj
X
= 0.5ml = 500 µL
(Sehingga CHCl3 yang digunakan adalah 500 µL)
ü Bobot kafein = 10.7 mg
Kadar
Kafein = 10.7 mg / 10 ml
= 10.7 mg / 0.01 L
= 1070 mg / L = 1070 bpj
ü Perhitungan Kafein ( yang dipakai )
-
Kadar Kafein 50 bpj
50µL . 1070 bpj = 1000 µL . x bpj
X = 53.5 bpj
-
Kadar Kafein 100 bpj
100µL . 1070 bpj = 1000 µL . x
bpj
X = 107 bpj
-
Kadar Kafein 200 bpj
200µL . 1070 bpj = 1000 µL . x
bpj
X = 214 bpj
-
Kadar Kafein 300 bpj
300µL . 1070 bpj = 1000 µL . x
bpj
X = 321 bpj
-
Kadar Kafein 400 bpj
400µL . 1070 bpj = 1000 µL . x
bpj
X = 428 bp
I. Bobot serbuk daun teh penimbangan awal
A. ( 5 menit ) = 1.0346 g = 1034.6 mg
B. (10 menit) = 1.0405 g = 1040.5 mg
C. (15 menit) = 1.0106 g = 1010.6 mg
II. Kadar yang diperoleh dari penimbangan awal (bpj)
·
5 menit à 1034.6 mg/50 ml = 1034.6 mg / 50 x 10-3
= 1034.6 mg / 0.05 L
=
20692 mg / L
=
20692 bpj
·
10 menit à 1040.5 mg/50 ml
= 1040.5 mg / 50 x 10-3
= 1040.5 mg / 0.05 L
=
20810 mg / L
=
20810 bpj
·
15 menit à 1010.6 mg/50 ml = 1010.6 mg / 50 x 10-3
= 1010.6 mg / 0.05 L
=
20212 mg / L
=
20212 bpj
III.
y = a + bx
a = 372.4012195
b = 0.432482334
r = 0.845168901
r2 = 0.714310471
|
|
Tabel Kadar vs kurva
penimbangan Kafein
|
Kadar (bpj)
|
Luas area
|
|
53.5
|
359.5
|
|
107
|
417.3
|
|
214
|
536.4
|
|
321
|
498.6
|
|
428
|
536.1
|
IV. Kadar Kafein dan hasil Pengamatan
|
Waktu ekstraksi
(sampel)
|
Luas area (y)
|
|
5 menit (A)
|
77.5
|
|
10 menit (B)
|
111.3
|
|
15 menit (C)
|
88.9
|
Perhitungan:
A. Waktu ekstraksi 5 menit
y
= a + bx
77.5 = 372.4012195 +
0.432482334 x
-294.9012199 = 0.432482334 x
X = -681.8803826 bpj
B. Waktu ekstraksi 10 menit
y = a + bx
111.3 = 372.4012195 +
0.432482334 x
-261.1012195 = 0.432482334 x
X = -603.7269014 bpj
C. Waktu ekstraksi 15 menit
y = a + bx
77.5 = 372.4012195 +
0.432482334 x
-283.5012195 = 0.432482334 x
X = -655.5209245bpj
V.
Kadar Kafein dalam masing-masing sampel
A.
Sampel dengan waktu
ekstraksi 5 menit
Kk = Kadar
Perhitungan x 100%
 Kadar
Penimbangan
Kadar
Penimbangan
=
-681.8803826 bpj x 100%
 20692
20692
= - 3.295381706 %
B.
Sampel dengan waktu
ekstraksi 10 menit
Kk = Kadar
Perhitungan x 100%
 Kadar
Penimbangan
Kadar
Penimbangan
=
-603.7269014 bpj x 100%
 20810
20810
= - 2.901138402 %
C.
Sampel dengan waktu
ekstraksi 15 menit
Kk = Kadar
Perhitungan x 100%
 Kadar
Penimbangan
Kadar
Penimbangan
=
-655.5209245bpj x 100%
 20212
20212
= - 3.243226422 %
Pengaruh waktu ekstraksi dilakukan
berdasarkan perbedaan lamanya waktu pemanasan daun teh. Lama
ekstraksi berhubungan dengan waktu kontak antara bahan dan pelarut. Semakin
lama waktu ekstraksi maka kesempatan untuk bersentuhan antara bahan dan pelarut
semakin besar sehingga kelarutan komponen solut dalam larutan akan meningkat.
Kestabilan bahan juga mempengaruhi waktu ekstraksi yaitu jika bahan aktif dari
suatu simplisia relatif stabil terhadap pemanasan maka tidak akan mempengaruhi
waktu ekstraksi. Sebaliknya, jika bahan aktif suatu simplisia tidak stabil
terhadap pemanasan maka akan waktu ekstraksi akan mempengaruhi kadar ekstrak
(semakin lama waktu pemanasan, kadar ekstrak akan semakin menurun).
Kafein hasil ekstraksi daun teh bersifat
stabil terhadap pemanasan, sehingga semakin lama ekstraksi maka kadarnya akan
tetap (konstan) dan bahkan cenderung naik. Percobaan dilakukan dengan pemanasan
pelarutan daun teh ditambah dengan CaCO3 dalam 5 menit, 10 menit dan 15 menit
dengan pengadukan konstan untuk meningkatkan hasil ekstraksi. Tujuan penambahan
CaCO3 adalah untuk mengeluarkan bahan-bahan yang terkandung dalam teh kering
secara keseluruhan (salah satunya adalah kafein yang merupakan alkaloid yang mengandung
nitrogen dan memiliki properti basa amina organik). Hal ini mengakibatkan
kafein keluar dari teh dan ikut larut dalam air. Sedangkan kandungan teh yang
lain seperti pigmen flavanoid dan klorofil yang tidak larut dalam CaCO3
dapat larut dalam air. Pada saat teh dan CaCO3 tercampur dalam satu
wadah, kedua zat tersebut tidak menyatu, hal ini dikarenakan CaCO3
adalah senyawa organik sedangkan teh adalah senyawa anorganik. Kemudian larutan
didinginkan dan disaring dengan penambahan kloroform pada corong pisah. Tujuan
penambahan kloroform adalah untuk mengikat kafein dari larutan agar kafein
benar-benar terpisah dari zat-zat lain dalam larutan. Setelah dipisahkan,
ditambahkan Natrium Sulfat Eksikatus yang berfungsi untuk menarik air yang
masih tertinggal pada larutan fase kloroform agar tidak terjadi kesalahan saat
penetapan kadar sampel secara KLT-Densitometri.
Hasil ekstraksi yang telah di dapat,
ditentukan kadarnya dengan metode KLT-densitometri. Pada metode ini, digunakan
fase diam yaitu silika gel 60 F254 dan fase geraknya adalah toluene-etil
asetat-dietil amin (7:2:1). Dibuat baku primer sebanyak 1000 bpj dan pada
silika gel ditotolkan sampel yang akan di hitung kadarnya yaitu pengenceran
50,100,200,300,dan 400 bpj. Silika gel bersifat polar sehingga dipakai pelarut
non polar agar lebih lama berada pada
fase gerak dan jarak yang ditempuh merupakan jarak terjauh dari kondisi awal
sebelum dielusi. Jarak migrasi senyawa pada plat silika gel tergantung pada
polaritasnya. Senyawa yang paling polar bergerak naik dengan jarak paling dekat
dari titik awal penotolan, sedangkan senyawa dengan polaritas paling kecil
bergerak paling jauh dari titik awal penotolan. Selanjutnya, untuk mengetahui
kadar kafein dari hasil ekstraksi maka dianalisis dengan densitometry dengan
lamda 276 nm. Data ini digunakan untuk perhitungan kadar kafein dalam
masing-masing sampel.
Pada kelompok kami, hasil
perhitungan kadar kafein pemanasan selama 5 menit adalah -3,295381706%. Hasil
perhitungan kadar kafein pemanasan selama 10 menit adalah -2,901138402%. Hasil
perhitungan kadar kafein pemanasan selama 15 menit adalah -3,243226422%. Hasil
yang kami dapatkan ini tidak sesuai dengan teori yang seharusnya konstan atau
cenderung naik. Hal ini disebabkan karena kesalahan dalam melakukan prosedur
kerja (penimbangan, pengocokan, waktu yang kurang tepat, kesalahan penotolan),
pencucian alat, dan kurangnya ketelitian praktikan saat praktikum.